Procedimiento para evaluar la degradación biológica del suelo en zonas áridas del noreste de México
Procedure for Assessing Biological Soil Degradation in Arid Zones of Northeastern Mexico
Emmanuel F. Campuzano,* Oscar Briones,** John Larsen,*** Gabriela Guillén-Cruz,* Fabián Fernández Luqueño* y Dulce Flores-Rentería****
* Centro de Investigación y de Estudios Avanzados (CINVESTAV) Unidad Saltillo, efcampuzano@gmail.com, gabriela.guillen@cinvestav.edu.mx y fabian.fernandez@cinvestav.edu.mx, respectivamente.
** Instituto de Ecología, A. C., oscar.briones@inecol.mx
*** Universidad Nacional Autónoma de México, jlarsen@cieco.unam.mx
**** CONACYT-CINVESTAV Unidad Saltillo, yaahid.flores@cinvestav.edu.mx
Nota: este proyecto se llevó a cabo con la financiación del Fondo Sectorial CONACYT-INEGI, proyecto 289644 Análisis de intercambio de carbono como indicador de su degradación biológica; los autores agradecen a Andrés Torres Gómez, Fernando Ayala y René Juárez Altamirano por su apoyo en el trabajo de campo; a los propietarios de los predios en los que se llevaron a cabo las mediciones por las facilidades prestadas; así como al Laboratorio de Análisis Químicos del CINVESTAV Unidad Saltillo por su contribución en la determinación de textura, carbono y nitrógeno total.
Vol. 13, Núm. 1 Epub Procedimiento para evaluar… Epub
|
Los suelos de ecosistemas áridos y semiáridos pueden presentar degradación biológica asociada al cambio de uso de suelo, la cual tiene como consecuencia la pérdida o disminución de la capacidad de estos para proporcionar servicios ambientales. Sin embargo, para poder evaluar el grado del daño, es necesario crear herramientas basadas en diferentes indicadores de calidad del suelo (ICS). Por consiguiente, en el presente estudio se identificaron los mejores ICS y sus valores umbrales, que ayudarán a evaluar esta problemática en el noreste árido de México. Para esto, se caracterizaron diferentes variables fisicoquímicas y biológicas de distintos usos de suelo (conservado, agrícola, ganadero, huerto e industrial). De acuerdo con los modelos de ecuaciones estructurales, la respiración del suelo, el pH, la biomasa microbiana y el carbono total fueron los principales indicadores del estado de degradación biológica, con pesos de regresión estandarizados de 0.56, -0.31, 0.18 y 0.14, respectivamente. Por último, se establecieron valores umbrales para cada indicador (teniendo en cuenta la estacionalidad, la cual determina, en gran medida, la actividad biológica en las zonas áridas), que constituyen el Índice de Degradación Biológica y representan un avance en la definición del tema de este trabajo. Palabras clave: indicador de degradación; respiración del suelo; temporalidad; uso de suelo.
|
Soils in arid and semi-arid ecosystems can show biological degradation associated with land use change, which results in the loss or reduction of their capacity to provide environmental services. However, in order to evaluate the degree of damage, it is necessary to create tools based on different soil quality indicators (SQI). Therefore, the present study identified the best SQIs and their threshold values, which will help to evaluate this problem in the arid northeastern part of Mexico. For this purpose, different physicochemical and biological variables of different land uses (conserved, agricultural, livestock, orchard and industrial) were characterized. According to structural equation models, soil respiration, pH, microbial biomass and total carbon were the main indicators of biological degradation status, with standardized regression weights of 0.56, -0.31, 0.18 and 0.14, respectively. Finally, threshold values were established for each indicator (taking into account seasonality, which determines, to a large extent, biological activity in arid zones), which constitute the Biological Degradation Index and represent an advance in the definition of the subject of this work.
Key words: degradation indicator; land use; soil respiration;seasonality.
|
Recibido: 20 de enero de 2021.
Aceptado: 25 de mayo de 2021.
Introducción
La degradación del suelo ha sido definida como la disminución de la capacidad del ecosistema para producir bienes o prestar servicios a sus beneficiarios (FAO, 2020). En las regiones áridas, este proceso (conocido como desertificación) es el resultado del cambio en el uso de suelo por las actividades antrópicas, aunado a las altas temperaturas y escasas precipitaciones pluviales que acentúan esta condición y promueven la fragmentación de los ecosistemas (Granados-Sánchez et al., 2013).
Las zonas áridas son de las regiones más vulnerables del planeta debido a su alta dependencia de las lluvias. En estos ecosistemas, la degradación del suelo se acentúa por la falta de agua, lo cual ocasiona que los organismos vivan en el límite de sus umbrales de supervivencia, haciéndolos particularmente sensibles (Muñoz-Iniestra et al., 2013). En México, la mayor superficie de tierras secas se encuentra en el norte, noreste y algunas partes del centro del país, ocupando alrededor de 125.3 millones de hectáreas (65 % del territorio nacional), de las cuales las zonas áridas (54 %) son las más comunes (CONAFOR-UACh, 2013).
Los suelos degradados poseen una calidad deficiente y, con ello, limitan la capacidad de los ecosistemas para proporcionar servicios ambientales y productivos. La degradación puede presentarse como física, química, biológica o ecológica (Lal, 2015) y se refiere, precisamente, a la alteración o pérdida de dichas propiedades del suelo. La física impide que este funcione de manera correcta (Muñoz-Iniestra et al., 2013) y puede manifestarse en la compactación y reducción de la estabilidad de los agregados, lo cual impide el intercambio de gases y agua (Osman, 2013). La química se manifiesta en forma de contaminación, salinización, acidificación, pérdida o distribución irregular de los nutrientes del suelo, pérdida de carbono y alteración de la actividad microbiana (Osman, 2013). Por otra parte, la biológica es la menos estudiada y se refiere a la pérdida o disminución de la microbiota y ha sido asociada a la degradación de materia orgánica por acción de la mineralización acelerada (Sims, 1990; Lal, 2015).
Para evaluar la condición edafológica, suelen emplearse indicadores de calidad del suelo (ICS), herramientas de medición que ofrecen información sobre las propiedades y procesos de este, los cuales son atributos medibles que revelan la respuesta de la productividad o funcionalidad del suelo al ambiente e indican si su calidad mejora, permanece constante o decrece. Por lo anterior, los ICS dan información acerca del efecto del cambio en el uso del suelo y el impacto de las prácticas humanas sobre su degradación y funcionamiento. Los indicadores pueden ser propiedades físicas (densidad aparente, textura y estructura), químicas (pH, conductividad eléctrica, concentración de nutrientes, contenido de materia orgánica) y biológicas o procesos biogeoquímicos (respiración del suelo, biomasa microbiana y actividad enzimática) que ocurren en él o se vinculan con otros sistemas. A pesar del reciente reconocimiento de la importancia del componente biológico del suelo en el mantenimiento de los servicios ambientales que provee, la cuantificación de su calidad ha sido dominada, principalmente, por indicadores químicos (Lehman et al., 2020). A la fecha, no existen aquellos que sean aplicables de manera universal, es decir, para todos los propósitos y contextos; por lo tanto, la evaluación de la calidad del suelo debe entenderse como un proceso regional específico, analizando los servicios que provee para establecer los mejores indicadores en cada caso (Estrada-Herrera et al., 2017; Lehman et al., 2020).
Uno de los principales ICS es el grado de funcionamiento del suelo estimado a través del intercambio de CO2, pues refleja una serie de procesos que involucran su estado físico y químico (pH, cantidad y calidad de nutrimientos, entre otros), así como su composición biológica heterotrófica (microorganismos, principalmente bacterias y hongos) y autotrófica (raíces de plantas) (Bautista et al., 2004; Cueva et al., 2016). Este intercambio de carbono del suelo hacia la atmósfera se le conoce como respiración del suelo (Rs), que es el resultado de la respiración autótrofa (exudados de las raíces y la rizósfera) y heterótrofa (metabolismo de macro y microorganismos del suelo) (Leon et al., 2014; Phillips y Nickerson, 2015). La Rs varía de manera estacional en los ecosistemas y está controlada, sobre todo, por la temperatura y humedad del suelo (Cueva et al., 2016). Es es un componente importante del ciclo del carbono y es considerada el segundo flujo más significativo entre los ecosistemas terrestres y la atmósfera. En consecuencia, cualquier alteración en las emisiones de CO2 en el suelo en respuesta al cambio ambiental podría tener un efecto sustancial al incrementar sus niveles (principal gas de efecto invernadero) en la atmósfera y proporcionar un impacto positivo al calentamiento global (Schlesinger y Andrews, 2000; Phillips y Nickerson, 2015). A pesar de su importancia, la inclusión del intercambio de CO2 en la determinación del concepto de calidad del suelo fue recientemente propuesta (Lehman et al., 2020).
En México, los cuatro principales mecanismos de degradación del suelo son las actividades industrial, agrícola y ganadera, así como la urbanización, relacionadas sobre todo con la acción humana, las cuales disminuyen su productividad biológica y su capacidad actual o futura para sostener la vida de las personas. Los datos más recientes indican que 45 % de los suelos del país presentan algún tipo de degradación inducida por el hombre (SEMARNAT, 2015).
Pese a que los estudios que abordan el proceso de la degradación de los suelos en México datan de mediados del siglo XX, sus resultados no son comparables debido, sobre todo, a diferencias metodológicas y objetivos de valoración (SEMARNAT, 2015). De manera similar, el efecto del cambio de uso de suelo sobre las propiedades edáficas en sistemas áridos ha sido poco explorado con unos cuantos estudios realizados en las regiones centro (Muñoz-Iniestra et al., 2013; Lüneberg et al., 2018) y norte del país (Hernández-Becerra et al., 2016). Dentro de ellos, se ha observado que la degradación física y biológica del suelo estuvo significativamente relacionada con la cobertura o uso del sitio en la cuenca de Zapotitlán Salinas, en el Valle de Tehuacán, Puebla (Muñoz-Iniestra et al., 2013). Por otro lado, en el Valle del Mezquital, Hidalgo, se demostró un efecto importante del cambio de uso del suelo (de matorral xerófilo al agrícola), estacionalidad (secas y lluvias) y variación en las prácticas de irrigación (secano, irrigación con agua dulce, residual y/o tratada) sobre las comunidades bacterianas del suelo (Lüneberg et al., 2018). Por último, los estudios más completos son los realizados en el norte de México, dentro de la región de Cuatro Ciénegas en Coahuila de Zaragoza, en los que Hernández-Becerra et al. (2016) y Tapia-Torres et al. (2018) mostraron que el cambio de uso de suelo (agrícola con alfalfa, agrícola abandonado y pastizal nativo) afectó la dinámica de los nutrientes y la composición de las comunidades bacterianas; los autores observaron diferencias en la composición microbiana entre sitios, denotando una mayor similitud entre los agrícolas (abandonado y alfalfa) respecto al pastizal.
Las zonas áridas y semiáridas del norte de México han sido afectadas por esta modificación de uso de suelo, producto de la conversión y pérdida de la cobertura vegetal del terreno a través de la implementación de actividades económicas y del crecimiento urbano no planificado, resultando necesario determinar su impacto sobre las características edáficas para generar herramientas que permitan monitorear de manera comparable el proceso de su degradación biológica. Por ello, para construir el Índice de Degradación Biológica del Suelo (IDBS), se plantearon varios objetivos para evaluar este problema en estos ecosistemas basado en el intercambio de carbono del suelo, así como los factores bióticos y abióticos que lo controlan: 1) determinar la variación de la Rs y condiciones ambientales entre los diferentes usos de suelo, 2) determinar la variación de las variables edáficas en temporada de lluvias y secas para los diferentes usos de suelo, 3) identificar los indicadores de degradación biológica del suelo a través de modelos de ecuaciones estructurales (SEM, por sus siglas en inglés) y 4) establecer los valores umbrales de los ICS mediante árboles de regresión multivariantes.
Materiales y métodos
Área de estudio
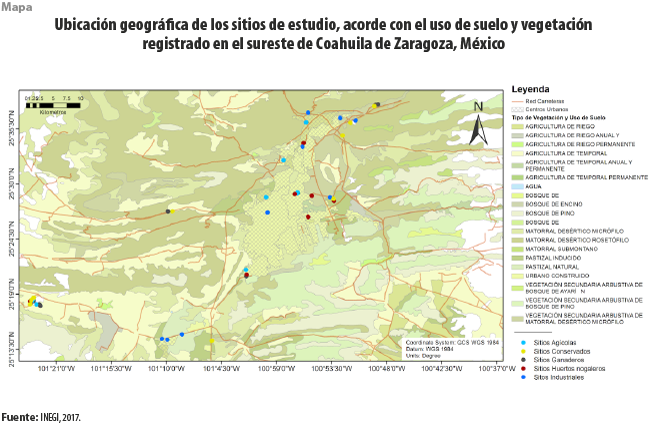
El análisis se llevó a cabo en los municipios de Saltillo, Ramos Arizpe y General Cepeda dentro del estado de Coahuila de Zaragoza, México (ver mapa). La región está localizada al este del Desierto Chihuahuense y su clima dominante es árido, semicálido, con temperatura media anual de 18 ºC (tipo BWhw) con una media máxima de 31 ºC en el mes más caluroso y una mínima de 4 ºC en el más frío; la precipitación media anual es de 386 mm, con la mayor cantidad en julio, agosto y septiembre (WorldClim, 2017); los tipos de suelo dominantes corresponden a Leptosoles y Cambisoles cálcicos, poco profundos y con fases físicas petrocálcicas y pedregosas (WRB, 2015); la topografía es caracterizada por valles y suaves colinas onduladas; la vegetación dominante es matorral xerófilo (Rzedowski, 2006). Dentro de esta área de estudio se eligieron los principales usos de suelo de la región: agrícola, ganadero, huerto de nogal (Carya illinoensis Koch), con influencia industrial y matorrales conservados (ver cuadro 1). Todos los sitios se encontraban en terrenos con inclinación menor a 5 grados.
Diseño de muestreo
Para cada uso de suelo, se eligieron nueve sitios, haciendo un total de 45. En cada uno se escogieron cinco puntos separados cada 30 m sobre un transecto lineal (N = 225). En cada punto se registró la Rs, temperatura ambiental (Ta), humedad relativa ambiental (HRa), luz fotosintéticamente activa (PAR, por sus siglas en inglés), temperatura (Ts) y humedad del suelo (Hs); además, se tomó una muestra para la determinación de la densidad aparente (DA), arena, limo, arcilla, carbono total (CT), nitrógeno total (NT), conductividad eléctrica (CE), pH, biomasa microbiana (BM), materia orgánica (MO) y de los elementos Al, Ca, Cl, Cr, Cu, Fe, K, Mg, Mn, Na, Ni, P, Pb, Si, S, Sr, Ti, Zn y Zr. El muestreo fue realizado de febrero a diciembre del 2019, durante el horario de máxima actividad de la Rs, de 12:00 a 16:00 horas (Matías et al., 2012). Para documentar la variación temporal, la Rs y las condiciones ambientales fueron registradas cada dos meses (febrero, abril, junio, agosto, octubre y diciembre), mientras que CE, pH, BM y MO se determinaron una vez durante la temporada de secas (febrero) y otra en la de lluvias (agosto). La DA, arena, limo, arcilla, CT, NT y el resto de los nutrientes del suelo antes mencionados fueron determinados solo en el primer muestreo (febrero) debido a que estudios previos en otras zonas áridas del país han demostrado poca variación estacional (Hernández-Becerra et al., 2016; Lüneberg et al., 2018).
Medición de variables y recolecta de datos
La Rs fue registrada con una cámara cerrada dinámica portátil (SRC-1; PP Systems, Amesbury, MA, USA), acoplada a un analizador de gases infrarrojo en un sistema de estado estable (EGM-5, PP Systems), que fue colocada sobre un anillo de PVC (10 cm de diámetro por 5 cm de altura) a 3 cm de profundidad del suelo, el cual fue situado 24 horas previas al muestreo para minimizar el impacto de su inserción y posible subestimación de la Rs de las raíces (Heinemeyer et al., 2011). La Ts y Hs fueron registradas a 8 cm de profundidad con una Hydra Probe II (Stevens), la Ta y HRa se midieron con una microestación WatchDog (mod. 1450) y la PAR, con un sensor MQ-200 (Apogee Instruments) a 1 m de altura.
Posterior a la medición de la Rs se tomó la muestra de suelo en cada punto, en los primeros 15 cm, las cuales fueron trasladadas al Laboratorio de Sustentabilidad del Suelo del Centro de Investigación y de Estudios Avanzados (CINVESTAV) Unidad Saltillo y almacenadas a 4 ºC hasta las determinaciones. Para la de la BM, se conservó una submuestra de suelo a -20 ºC; el resto se secó a temperatura ambiente (dentro de un invernadero) hasta peso constante para luego tamizarse a 2 mm; el pH y la CE fueron determinados en una suspensión acuosa 1:2.5 (p:v) con los equipos Thermo Scientific Orion Star A211 y Orion Star A212, respectivamente; la BM, por el método rápido de fumigación-extracción (Gregorich et al., 1990); la MO se evaluó por el de pérdida por ignición a 400 ºC durante cuatro horas y la DA, por el volumétrico de probeta. La textura del suelo (arena, limo y arcilla) se determinó mediante granulometría con un analizador de partículas Horiba LA 950 V2. La cantidad de CT y NT fue medida por combustión flash dinámica con el método de Dumas modificado (Krotz et al., 2016) y empleando un analizador elemental CHNS-O (FlashSmart modelo 2000, Thermo Fisher Scientific). La concentración total de los nutrientes del suelo se determinó a través de fluorescencia de rayos X (Bruker S4 Pioneer).
Análisis de datos
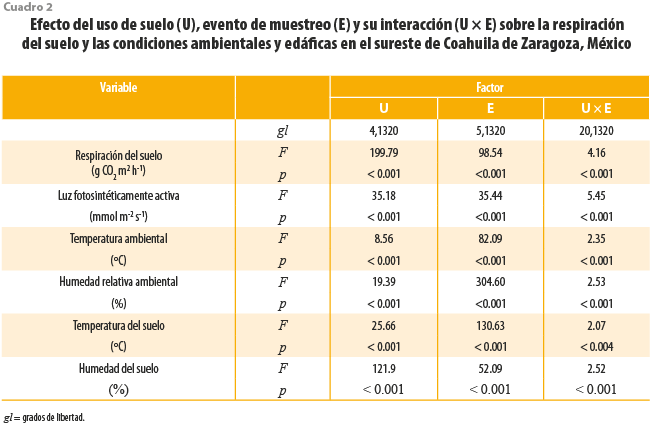
La limpieza de estos consistió en aplicar el método de Tukey para identificar los atípicos y eliminar aquellos que correspondieran a errores de medición (Kannan et al., 2015). Los faltantes fueron imputados implementando el algoritmo de random forests (Stekhoven y Bühlmann, 2012). La variación en la Rs, variables ambientales, CE, pH, BM y MO fueron estudiadas mediante análisis de varianza (ANOVA, por sus siglas en inglés) de dos factores: uso de suelo y evento de colecta. Se realizaron ANOVA de un factor y pruebas post hoc de Tukey HSD para evaluar las diferencias entre los usos de suelo y diferentes eventos de muestreo.
Para reducir la dimensión de los datos de los nutrientes del suelo, se realizó un análisis de componentes principales (PCA, por sus siglas en inglés). Los dos resultantes que explicaron la mayor variación de los datos fueron empleados en análisis posteriores. El grado de correlación entre los nutrientes y niveles de uso de suelo se representó mediante la construcción de un gráfico de ordenación. Las diferencias entre los niveles de uso de suelo fueron analizadas a través de la elaboración de elipses de confianza en el gráfico. Previo al PCA, los datos se escalaron con media 0 y desviación estándar 1 para que las variables fuesen comparables y reducir el error por la inclusión de diferentes escalas de medición. Los ANOVA y el PCA (α = 0.05) fueron realizados en el programa R (R Core Team, 2019).
Se utilizaron los SEM para seleccionar los indicadores de la degradación biológica del suelo (DBS, especificada como variable latente), considerando los diferentes ICS. Para estos modelos, se planteó la hipótesis de que los distintos ICS medidos serían buenos parámetros de la DBS, en especial los relacionados con la funcionalidad (Rs) y cantidad de microorganismos en el suelo (BM). Se consideró el uso de suelo como una variable exógena del sistema, utilizando como aproximación el coeficiente metabólico promedio estimado para cada uso de suelo, calculado como qCO2 = (Rs * BM)/MO) (Stevenson et al., 2016). Se analizaron distintos modelos probando el efecto de las 10 variables ambientales y edáficas registradas, más la información de los 19 nutrientes (reducida a dos dimensiones mediante el PCA: PC1 y PC2) sobre la variable latente (DBS).
Para los modelos finales, se establecieron otros con cuatro, cinco y seis indicadores, eliminando progresivamente aquellos ICS no significativos. Se eligió el mejor modelo como aquel que explicó la mayor proporción de la varianza de la variable latente, utilizando, también, el criterio de información de Akaike para la selección del más parsimonioso, siendo el final: DBS =~ Rs + CT + pH + BM; DBS ~ qCO2. El SEM consideró un conjunto de hipótesis basadas en la literatura de la forma en que la cantidad de BM se vería afectada por el CT y el pH (BM ~ CT + pH), por lo que se incluyó la relación causal correspondiente en los modelos (Wardle, 1992). De igual manera, se consideró que el CT estaría correlacionado con el pH (CT ~~ pH; Kemmitt et al., 2006; Yang et al., 2012). Se calcularon los coeficientes de trayectoria estandarizados con el algoritmo de máxima verosimilitud (Shipley, 2002); el grado de ajuste entre las estructuras de covarianza observadas y esperadas en los SEM se evaluó mediante el error cuadrático medio de la estadística de aproximación (RMSEA) (Steiger, 1990; MacCallum et al., 1996); el ajuste del modelo a los datos se evaluó adicionalmente con los índices de Bondad del Ajuste (GFI, por sus siglas en inglés) y de Ajuste Normado (NFI, por sus siglas en inglés) de Bentler y Bonett (Iriondo et al., 2003); además, se establecieron intervalos de confianza a 95 %, basados en un remuestreo en percentiles para la corrección de sesgo, utilizando 2 mil muestras. Los SEM se ajustaron con los programas SPSS® y SPSS® AMOS 20.0 (IBM Corporation Software Group, Somers, NY).
Una vez identificados los mejores indicadores de la degradación biológica del suelo a través de los SEM, se determinaron los valores umbrales de los ICS empleando árboles de regresión multivariante como modelos predictivos (De’ath, 2002).
En este caso, se utilizó como variable categórica el coeficiente metabólico promedio por uso de suelo (qCO2) y como explicativas, los ICS identificados en el SEM como sigue: qCO2 ~ Rs + pH + CT + BM. Se construyeron árboles que identificaron grupos homogéneos de sitios en sus hojas (de acuerdo con el coeficiente metabólico que presentaban), permitiendo caracterizarlos mediante los umbrales de las variables explicativas. El análisis se realizó utilizando los paquetes rpart y rpart.plot en R (R Core Team, 2019). El último paso en la definición de los grados de DBS consistió en interpretar los sitios homogéneos como tal (hojas en el árbol de regresión multivariante); cada grado se caracterizó por la ruta en el árbol de regresión desde el nodo raíz hasta su hoja, ruta que se interpretó como la conjunción de las condiciones en los indicadores que está involucrada en los nodos. Debido a que los procesos biológicos del suelo son fuertemente dependientes de las condiciones climáticas, los valores umbrales de los indicadores fueron diferentes a lo largo del año, por lo que se definieron los de cada indicador para las épocas seca y lluviosa agrupando los registros de los datos en los meses con mayor semejanza climática.
Resultados
Condiciones climáticas y edáficas
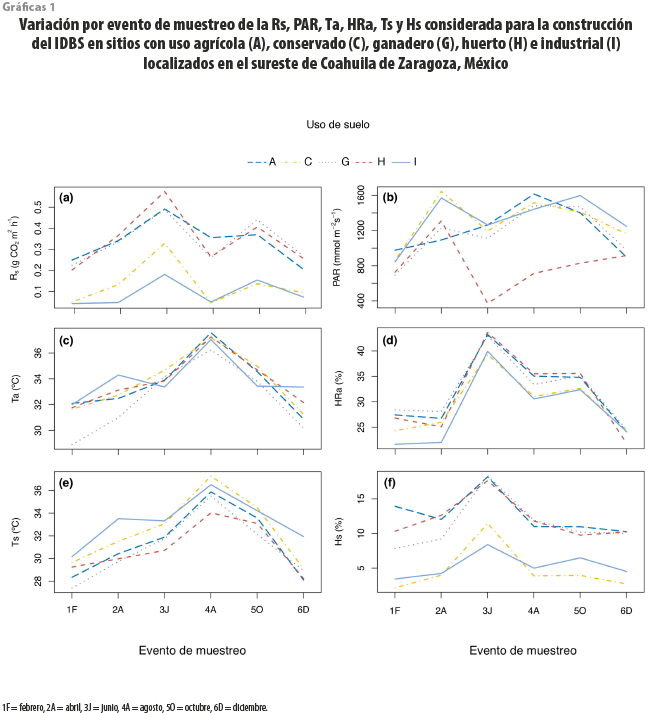
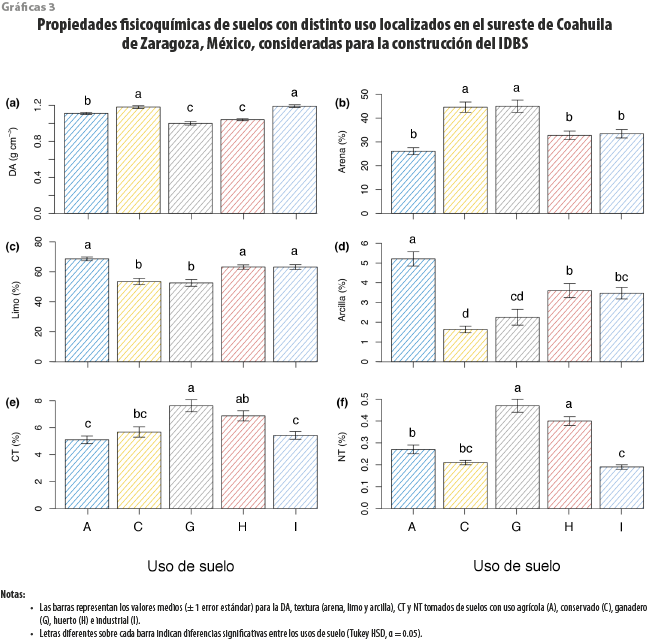
Los resultados de los ANOVA mostraron que la variación de la Rs y las condiciones ambientales dependieron significativamente (p < 0.01) de la interacción entre el tipo de uso del suelo y mes del año (ver cuadro 2 y gráficas 1a-f). La mayor y menor Rs se registraron en los sitios ganaderos en junio y en las zonas industriales, en febrero, respectivamente (ver gráfica 1a); la PAR mostró su valor más alto en espacios conservados en abril y el menor, en los sitios con huertos en junio (ver gráfica 1b). La mayor Ta se presentó en los agrícolas en agosto, mientras que la menor se dio en los ganaderos en febrero (ver gráfica 1c). La HRa más alta se registró en los huertos en junio, mientras que la menor, en los industriales durante febrero (ver gráfica 1d). La Ts fue más elevada en los sitios conservados en agosto, con sus valores más bajos registrados en los ganaderos en febrero (ver gráfica 1e). La Hs presentó sus valores más altos en los sitios ganaderos durante junio y los más bajos, en los conservados durante febrero (ver gráfica 1f).
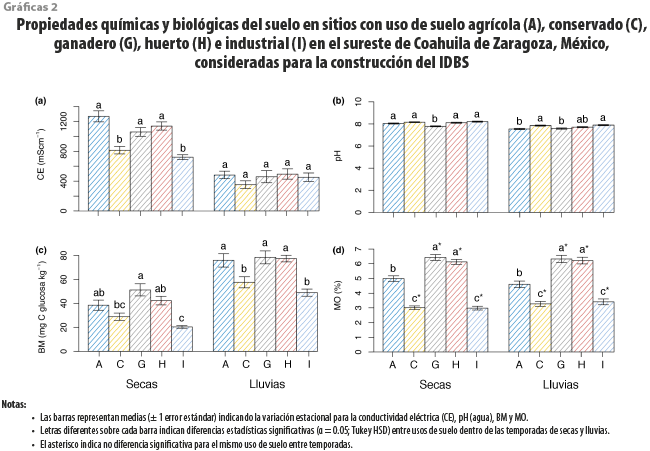
Las variables edáficas CE, pH, BM y MO también mostraron variación significativa (p < 0.001; ver Anexo cuadro 1A) respecto a los efectos principales de uso de suelo y de temporada. De estas, solo la CE y MO presentaron un efecto de interacción significativo (p < 0.05; ver Anexo cuadro 1A). La mayor CE se registró en sitios agrícolas en temporada de secas, mientras que la menor, en los conservados durante la de lluvias (ver gráfica 2a). El mayor y menor pH se obtuvo en áreas industriales durante la temporada de secas y en agrícolas en la de lluvias, respectivamente (ver gráfica 2b). La BM tuvo mayor valor en los ganaderos durante el periodo de lluvias y menor en los industriales en el de sequía (ver gráfica 2c). Finalmente, la MO fue mayor en sitios ganaderos y menor en los conservados e industriales, sin presentar diferencias entre temporadas para todos los usos de suelo (ver gráfica 2d).
Propiedades del suelo
Las físicas (DA y textura), así como la concentración de CT y NT del suelo, mostraron diferencias significativas (p < 0.001) con respecto al uso de suelo (ver Anexo cuadro 1A). La mayor DA se registró en los sitios conservados y con influencia industrial, mientras la menor, en los ganaderos (ver gráfica 3a). Todos los sitios presentaron textura de suelo franco limoso, aunque mostraron diferencias en la proporción del tamaño de las partículas minerales. El porcentaje más alto de arena se observó en los ganaderos, mientras que el menor se registró en los agrícolas (ver gráfica 3b). Las zonas agrícolas presentaron la mayor cantidad de limo y la menor, las ganaderas (ver gráfica 3c). El porcentaje de arcilla fue mayor en los sitios agrícolas, mientras que el menor, en los conservados (ver gráfica 3d). Las concentraciones de CT y NT fueron más elevadas en los sitios ganaderos y menores en los agrícolas e industriales, respectivamente (ver gráficas 3e-f).
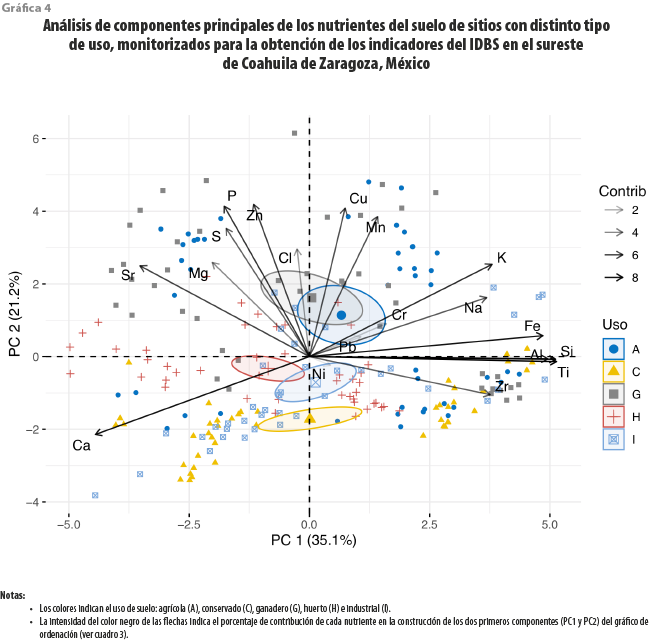
Respecto a la concentración de nutrientes, los primeros dos componentes del PCA explicaron 56.4 % de la variación total de estos en el suelo (ver gráfica 4), denotando valores propios (eigenvalues) elevados. De los 19 nutrientes incluidos en el modelo, 17 estuvieron significativamente correlacionados con el PC1 y 13, con el PC2. El gráfico de ordenación evidenció diferencias en la composición de nutrientes en función de las condiciones de uso de suelo, donde la mayor cantidad de elementos químicos estuvo relacionada en más medida con sitios con uso agrícola y ganadero. El PC1 mostró asociación positiva con sitios agrícolas, pero fue asociado de manera negativa con los huertos. El mismo componente presentó fuertes correlaciones positivas con Al2O3, SiO2, TiO2, Fe2O3 y fuerte correlación negativa con CaO. Por otro lado, el PC2 mostró asociaciones positivas con sitios agrícolas y ganaderos, mientras que para los industriales, conservados y huertos fueron negativas. El PC2 expuso fuertes correlaciones positivas con ZnO, P2O5, CuO y MnO (ver cuadro 3).
Selección de indicadores de la DBS
Con combinaciones de los indicadores se generaron 30 modelos para explicar la variable latente, es decir, la degradación biológica del suelo. Para seleccionar el mejor, se utilizó el porcentaje de explicación de esta, probando las distintas variables medidas como indicadores de la DBS. Los modelos mostraron una R2 con un rango de 32-84 % para la variable latente. Se eligió el modelo que explicara el mayor porcentaje de variación y el mejor ajuste de acuerdo con el criterio de información de Akaike.
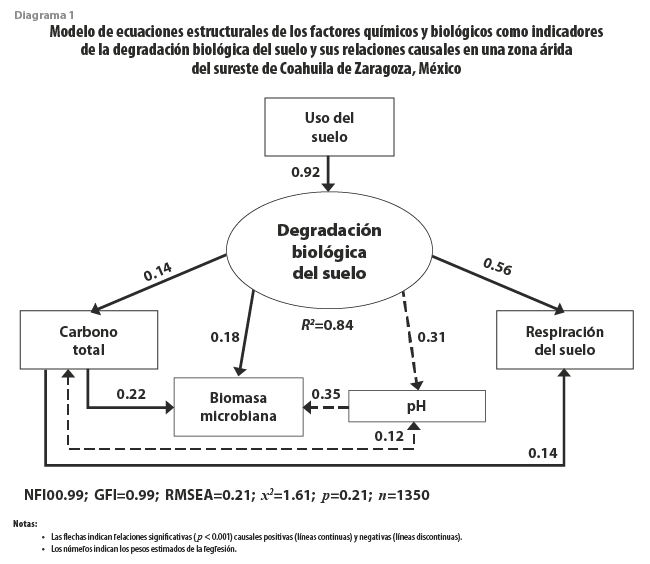
De acuerdo con los indicadores NFI = 0.99, GFI = 0.99 y RMSEA = 0.021, el modelo seleccionado mostró un buen ajuste asociado a la heterogeneidad de los datos y explicó 84 % de la variación de la DBS (ver diagrama 1). Conforme a este modelo, los mejores indicadores de la degradación biológica del suelo fueron la Rs, pH, BM y CT, con pesos de regresión estandarizado (PRE) de 0.56, -0.31, 0.18 y 0.14, respectivamente, que proporcionan PRE para predecir las variables no observadas a partir de las observadas. A su vez, el CT explicó la variabilidad de la Rs y la BM mostrada y esta última fue también afectada por el pH, el cual estuvo correlacionado con el CT.
Umbrales de los indicadores de la DBS
Las hojas finales de los árboles de regresión multivariada construidos para buscar los valores de los indicadores de la degradación biológica para las estaciones de secas y lluvias se identificaron como distintos grados de DBS. Los árboles mostraron una probabilidad de la clase ajustada entre 0.49 y 0.81, indicando buena predicción en la clasificación de la variable explicativa (ver diagrama 2).
La Rs fue la primera variable explicativa que permitió minimizar la varianza intranódica del coeficiente metabólico del suelo, con valores mínimos durante la época de secas (0.13 g CO2 m2 h-1), en comparación con la de lluvias (0.27 g CO2 m2 h-1). Los valores umbrales de CT tuvieron un intervalo entre 6.7 y 8.3 % para identificar suelos con mayor DBS (severa y degradados) de los que presentaron una menor (moderada, ligera y sin degradación aparente) entre las temporadas de lluvias y secas, respectivamente. El pH mostró valores umbrales de 7.9 en época de secas para identificar los suelos sin degradación o con una moderada de aquellos que la presentaron de forma ligera y de 7.1 para diferenciar entre suelos sin degradación de los que mostraron una DBS ligera. Por otro lado, los árboles de regresión multivariada no identificaron a la BM en la reducción de la varianza intranódica en el nivel de segregación de la variable explicativa (ver diagrama 2).
Discusión
Heterogeneidad ambiental
Para que los indicadores de degradación biológica puedan ser comparables entre los sitios analizados en el presente estudio, se debe considerar la heterogeneidad ambiental a las escalas regional y microclimática. Por lo anterior, el diseño de muestreo empleado en este trabajo incluyó los elementos temporales y de cambio de uso de suelo de mayor representatividad en la región. Los resultados muestran un efecto conjunto de la variación temporal y del cambio de uso de suelo sobre cada una de las condiciones ambientales analizadas, con diferencias tanto entre eventos de muestreo dentro de un mismo uso de suelo como entre los diferentes usos en un determinado evento de muestreo (ver gráficas 2a-f). Este impacto de interacción detectado es congruente con estudios que señalaron la existencia de una marcada estacionalidad, aun bajo las condiciones semiáridas predominantes de la región (Mendoza-Hernández y González-Aldaco, 2017). En particular, la respiración del suelo en este tipo de ecosistemas es fuertemente influenciada por la variación espacio-temporal de la temperatura (Leon et al., 2014; Cueva et al., 2016) y precipitación (Xu et al., 2004). Estudios realizados en otras zonas semiáridas del norte de México también registraron una marcada heterogeneidad microclimática entre sitios con diferente uso de suelo, coincidiendo con nuestros resultados (Pontifes et al., 2018; Sánchez-Reyes et al., 2019). Esto soporta el hecho de que, pese a la condición semiárida predominante en la región, la heterogeneidad microclimática y ambiental debe ser considerada tal y como se plantea en la medición de los indicadores de degradación biológica aquí propuestos.
Indicadores de degradación biológica y su dinámica espacio-temporal
El presente estudio representa una de las primeras aproximaciones para evaluar DBS, identificando aquellas variables ambientales y edáficas más sensibles a los cambios de uso de suelo en zonas áridas del norte de México (SEMARNAT, 2015), especialmente considerando que se trata de una aproximación holística multicriterio (múltiples indicadores), como ha sido propuesto en revisiones recientes (e. g., Lehmann et al., 2020) y que tiene en cuenta, además, la dinámica temporal de las zonas áridas.
De los cuatro indicadores que explicaron mejor la degradación biológica del suelo, la Rs fue la variable con mayor peso (ver diagrama 1), coincidiendo con autores que la han señalado como indicador clave para determinar la calidad del suelo (Bautista et al., 2004; Lal, 2015; Lehmann et al., 2020) y la consideraron el mejor indicador de la actividad metabólica de las poblaciones microbianas del suelo (Machulla, 2003). El patrón observado para la Rs en este trabajo reveló un efecto de interacción significativo entre el uso de suelo y los eventos de muestreo, coincidiendo con lo mencionado por Cueva et al. (2016) y Vargas et al. (2010), quienes demostraron que esta variable presenta una dinámica espacio-temporal compleja a diferentes escalas, la cual ha sido registrada previamente en otras zonas áridas del norte de México, donde Leon et al. (2014) demostraron que la variación temporal para el flujo de CO2 del suelo es influenciada, sobre todo, por los cambios mensuales de precipitación y temperatura de este, además de denotar una fuerte dependencia espacial dentro de la misma zona de estudio.
La segunda variable de mayor peso fue el pH, cuya dinámica fue caracterizada por diferencias significativas entre usos de suelo y eventos de muestreo, con un efecto de interacción no significativo (ver cuadro 2). Pese a que se ha observado que el pH no cambia significativamente en diferentes tipos de pastizales de zonas semiáridas en Nuevo México, Estados Unidos de América (Thapa et al., 2018); otros estudios soportan el efecto del cambio de uso de suelo registrado en el presente estudio (Panday et al., 2019; Yan et al., 2019); en particular, se ha observado que suelos agrícolas o ganaderos con alta concentración de nitrógeno en forma de amonio promueven una rápida nitrificación y liberación de iones H+, disminuyendo el pH del suelo (Moore et al., 2000). Esto coincide con el menor pH (ver gráfica 2b) y la mayor cantidad de NT (ver gráfica 3f) registrados en los sitios ganaderos evaluados en esta investigación (ver gráficas 2 y 3).
Respecto a la dinámica del CT y BM, se registró un efecto causal directo del primero sobre la segunda (ver diagrama 1), además de una respuesta diferencial para ambas variables entre temporadas y usos de suelo (ver gráficas 2). El efecto estacional y cambio de uso de suelo sobre la BM ha sido previamente demostrado en otras zonas áridas (Saynes et al., 2012; Hernández-Becerra et al., 2016; Lüneberg et al., 2018), estudios que también demuestran que el incremento de la concentración de CT potencia el metabolismo heterótrofo bacteriano, estimulando su fijación en la biomasa de sus comunidades microbianas. En este sentido, las diferencias estacionales observadas en el presente trabajo para la concentración de CT en sitios agrícolas, respecto a su relativa estabilidad en el resto de los usos de suelo (ver gráficas 2), pueden ser atribuidas a las diferentes prácticas de manejo, pues se ha demostrado que actividades como la labranza, el barbecho y la fertilización, propias de los agrícolas, afectan de manera negativa la permanencia del carbono del suelo (Murty, 2002; McLauchlan, 2006).
Pese a que la acidificación del suelo es un tema de importancia global para el manejo sustentable de este, además de afectar de manera crucial al ciclo del carbono (Yang et al., 2012), existe escaso conocimiento sobre la relación del pH y el contenido de carbono del suelo. Esto es, en parte, debido a la compleja dinámica espacial del pH en respuesta a cambios tanto estructurales (material parental, topografía, clima) como aleatorios (biología del suelo, disturbio humano, diseño de muestro y errores de medición) (Yan et al., 2019). No obstante, el efecto de correlación negativo entre el pH y CT, desplegado en el modelo de ecuaciones estructurales (ver diagrama 1), ha sido previamente reportado en suelos con distinto uso en China y Tailandia (Jin y Wang, 2018; Zhou et al., 2019), remarcando el efecto del cambio de uso de suelo como factor determinante. En el presente estudio, la relación negativa entre pH y CT es claramente demostrada en los sitios ganaderos analizados, que presentaron la mayor concentración de CT (ver gráfica 3e) y el menor pH (ver gráfica 2b). Como se ha argumentado con anterioridad, la elevada concentración de compuestos orgánicos en estos sitios, derivados de las excretas de ganado, pueden contribuir en la subsecuente liberación de H+ como resultado de su descomposición, disminuyendo su pH (Moore et al., 2000).
La variación temporal derivada de la fuerte dependencia funcional de los ecosistemas áridos a la disponibilidad de agua fue incorporada con la identificación de valores umbrales para las variales indicadoras en cada estación (lluvias y secas). La discriminación de los grados de degradación biológica del suelo basada en la combinación de indicadores de su funcionalidad del suelo (Rs) y filtros ambientales como el pH y el contenido de CT, con la modelación de árboles de regresión multivariantes, ha sido ya documentada, modelando la comunidad microbiana del suelo a nivel regional dentro de otros países (Karim et al., 2020). La aplicación de estas técnicas en futuros estudios permitirá la identificación de distintos grados de DBS, independientemente de la estación en la que se realicen las mediciones.
De este modo, la identificación de los mejores indicadores de la degradación biológica del suelo y la definición de sus valores umbrales para cada grado de degradación en zonas áridas constituye un avance en el entendimiento de los parámetros que se ven afectados por el cambio de uso de suelo, que comprometen la funcionalidad biológica de este. Finalmente, el Índice de Degradación Biológica del Suelo propuesto implica la aplicación de un sistema de cuantificación para la DBS con mediciones sencillas, facilitando su aplicación en futuros estudios.
Conclusiones
El presente trabajo es pionero en diseñar un protocolo para la evaluación de la degradación biológica de los suelos en zonas áridas del noreste de México. Los indicadores propuestos señalan distintos grados de DBS asociados a la respiración del suelo, así como diversas variables químicas y biológicas del suelo, contenido de carbono total y pH. Se identificó a la Rs, pH, biomasa microbiana y carbono total como aquellas variables que explican, en mayor medida, la degradación del suelo dentro del área de estudio analizada. En específico, los resultados refuerzan la idea de que la respiración del suelo es un buen indicador de la calidad de su estado biológico. La identificación de los valores umbrales para cada uno de los indicadores propuestos para la construcción del Índice de Degradación Biológica del Suelo permitirá determinar con relativa facilidad el grado de DBS bajo estos contextos ambientales que son recurrentes en los ecosistemas áridos del norte de México.
Fuentes
Bautista, A., J. Barra, R. F. del Castillo y C. Gutiérrez. “La calidad del suelo y sus indicadores”, en: Ecosistemas. 13, 2. 2004, pp. 90-97.
Byrne, B. M. “Testing for multigroup invariance using AMOS graphics: A road less traveled”, en: Structural Equation Modeling. 11, 2. 2004, pp. 272-300.
CONAFOR-UACh. Línea base nacional de degradación de tierras y desertificación. Informe final. Zapopan, Jalisco, México, Comisión Nacional Forestal-Universidad Autónoma Chapingo, 2013.
Cueva, A., C. A. R. Zazueta, J. Garatuza y E. A. Yépez. “Soil respiration in Mexico: Advances and future directions”, en: Terra Latinoamericana. 34, 3. 2016, pp. 253-269.
De’ath, G. “Multivariate regression trees: a new technique for modeling species-environment relationships”, en: Ecology. 83. 2002, pp. 1105-1117.
Estrada-Herrera, I. R., C. Hidalgo-Moreno, R. Guzmán-Plazola, J. J. Almaraz, H. Navarro-Garza y J. D. Etchevers-Barra. “Indicadores de calidad de suelo para evaluar su fertilidad”, en: Agrociencia. 51, 8. 2017, pp. 813-831.
FAO. Food and Agriculture Organization of the United Nations. FAO Soils Portal (DE) consultado el 20 de junio de 2020 en https://bit.ly/3tMPcdB
Granados-Sánchez, D., M. Á. Hernández-García, A. Vázquez-Alarcón y P. Ruíz-Puga. “Los procesos de desertificación y las regiones áridas”, en: Revista Chapingo. Serie Ciencias Forestales y del Ambiente. 19. 2013, pp. 45-66.
Gregorich, E. G., G. Wen, R. P. Voroney y R. G. Kachanoski. “Calibration of a rapid direct chloroform extraction method for measuring soil microbial biomass C”, en: Soil Biology and Biochemistry. 22, 7. 1990, pp. 1009-1011.
Heinemeyer, A., C. Di Bene, A. R. Lloyd, D. Tortorella, R. Baxter, B. Huntley, A. Gelsomino y P. Ineson. “Soil respiration: Implications of the plant-soil continuum and respiration chamber collar-insertion depth on measurement and modelling of soil CO2 efflux rates in three ecosystems”, en: European Journal of Soil Science. 62. 2011, pp. 82-94.
Hernández-Becerra, N., Y. Tapia-Torres, O. Beltrán-Paz, J. Blaz, V. Souza y F. García-Oliva. “Agricultural land-use change in a Mexican oligotrophic desert depletes ecosystem stability”, en: PeerJ. 8. 2016, DOI: 10.7717/peerj.2365.
INEGI. Conjunto de datos vectoriales de la carta de uso del suelo y vegetación. Escala 1:250 000. Serie VI (conjunto nacional). Aguascalientes, México, INEGI, 2017.
_______ Conjunto de datos vectoriales edafológicos. Escala 1: 250 000. Serie II (continuo nacional). Aguascalientes, México, INEGI, 2014.
Iriondo, J. M., M. J. Albert y A. Escudero. “Structural equation modelling: An alternative for assessing causal relationships in threatened plant populations”, en: Biological Conservation. 113, 3. 2003, pp. 367-377.
Jin, S. y H. Wang. “Relationships between soil pH and soil carbon in China’s carbonate soils”, en: Fresenius Environmental Bulletin. 27. 2018, pp. 605-611.
Kannan, K. S., K. Manoj y S. Arumugam. “Labeling methods for identifying outliers”, en: International Journal of Statistics and Systems. 10, 2. 2015, pp. 231-238.
Karimi, B., J. Villerd, S. Dequiedt, S. Terrat, N. Chemidlin-Prévost Bouré, C. Djemiel, M. Lelièvre, J. Tripied, V. Nowak, N. P. A. Saby, A. Bispo, C. Jolivet, D. Arrouays, P. Wincker, C. Cruaud y L. Ranjard. “Biogeography of soil microbial habitats across France”, en: Global Ecology and Biogeography. 29. 2020, pp. 1399-1411.
Kemmitt, S. J., D. Wright, K. W. T. Goulding y D. L. Jones. “pH regulation of carbon and nitrogen dynamics in two agricultural soils”, en: Soil Biology and Biochemistry. 38. 2006, pp. 898-911.
Krotz, L., F. Leone y G. Giazzi. “Nitrogen/Protein Determination in Food and Animal Feed by Combustion Method (Dumas) using the Thermo Scientific Flash Smart Elemental Analyzer”, en: Application Note, Thermo Fisher. 2016.
Lal, R. “Restoring Soil Quality to Mitigate Soil Degradation”, en: Sustainability. 7, 5. 2015, pp. 5875-5895.
Lehmann, J., D. A. Bossio, I. Kögel-Knabner y M. C. Rillig. “The concept and future prospects of soil health”, en: Nature Reviews Earth & Environment. 1,10. 2020, pp. 544-553.
Leon, E., R. Vargas, S. Bullock, E. Lopez, A. R. Panosso y N. La Scala. “Hot spots, hot moments, and spatio-temporal controls on soil CO2 efflux in a water-limited ecosystem”, en: Soil Biology and Biochemistry. 77. 2014, pp. 12-21.
Lüneberg, K., D. Schneider, C. Siebe y R. Daniel. “Drylands soil bacterial community is affected by land use change and different irrigation practices in the Mezquital Valley, Mexico”, en: Scientific Reports. 8. 2018, pp. 1-15.
MacCallum, R. C., M. W. Browne y H. M. Sugawara. “Power analysis and determination of sample size for covariance structure modeling”, en: Psychological Methods. 1, 2. 1996, pp. 130-149.
Machulla, G. “Soil microbial indicators and their environmental significance”, en: Journal of Soils and Sediments. 3. 2003, pp. 229-229.
Matías, L., J. Castro y R. Zamora. “Effect of Simulated Climate Change on Soil Respiration in a Mediterranean-Type Ecosystem: Rainfall and habitat type are more important than temperature or the soil carbon pool”, en: Ecosystems. 15, 2. 2012, pp. 299-310.
McLauchlan, K. “The nature and longevity of agricultural impacts on soil carbon and nutrients: A review”, en: Ecosystems. 9, 8. 2006, pp. 1364-1382.
Mendoza-Hernández, J. M. y S. X. González-Aldaco. “Clima”, en: CONABIO-Gobierno del estado de Coahuila de Zaragoza. La biodiversidad en Coahuila. Estudio de estado. Volumen I. Ciudad de México, CONABIO-Gobierno del estado de Coahuila de Zaragoza, 2017, pp. 45-54.
Moore, J. M., S. Klose y M. A. Tabatabai. “Soil microbial biomass carbon and nitrogen as affected by cropping systems”, en: Biology and Fertility of Soils. 31. 2000, pp. 200-210.
Muñoz-Iniestra, D. J., M. Ferreira-Ramírez, I. B. Escalante-Arriaga y J. L. López-García. “Relación entre la cobertura del terreno y la degradación física y biológica de un suelo aluvial en una región semiárida”, en: Terra Latinoamericana. 31, 3. 2013, pp. 201-210.
Murty, D., M. U. F. Kirschbaum, R. E. Mcmurtrie y H. Mcgilvray. “Does conversion of forest to agricultural land change soil carbon and nitrogen? A review of the literature”, en: Global Change Biology. 8, 2. 2002, pp. 105-123.
Osman, K. T. “Soil degradation, conservation and remediation”, en: Soil Degradation, Conservation and Remediation. Springer, Dordrecht, 2013, pp. 125-148.
Panday, D., R. B. Ojha, D. Chalise, S. Das y B. Twanabasu. “Spatial variability of soil properties under different land use in the Dang district of Nepal”, en: Cogent Food & Agriculture. 5. 2019, pp. 1-9.
Phillips, C. L. y N. Nickerson. “Soil respiration”, en: Reference Module in Earth Systems and Environmental Sciences. Elsevier, 2015, pp. 1-20.
Pontifes, P. A., P. M. García-Meneses, L. Gómez-Aíza, A. I. Monterroso-Rivas y M. Caso-Chávez. “Land use/land cover change and extreme climatic events in the arid and semi-arid ecoregions of Mexico”, en: Atmósfera. 31, 4. 2018, pp. 355-372.
R Core Team. R: A language and environment for statistical computing. Version 3.5.0, 2019 (DE) https://bit.ly/3NvWGtC
Rzedowski, J. Vegetación de México. México, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, 2006.
Sánchez-Reyes, U. J., S. Niño-Maldonado, L. Barrientos-Lozano, J. Treviño-Carreón y P. Almaguer-Sierra. “Seasonal microclimatic variation in a succession gradient of low thorn forest in Northeastern Mexico”, en: Revista de Biología Tropical. 67. 2019, pp. 266-277.
Saynes, V., J. D. Etchevers, L. Galicia, C. Hidalgo y J. Campo. “Soil carbon dynamics in high-elevation temperate forests of Oaxaca (Mexico): thinning and rainfall effects”, en: Bosque. 33. 2012, pp. 3-11.
Schlesinger, W. H. y J. A. Andrews. “Soil respiration and the global carbon cycle”, en: Biogeochemistry. 48, 1. 2000, pp. 7-20.
SEMARNAT. Suelos. Informe de la situación del medio ambiente en México. Compendio de estadísticas, indicadores clave, de desempeño ambiental y de crecimiento verde. 2015 (DE) consultado el 21 de junio de 2020 en https://bit.ly/3Lg6o1c
Shipley, B. Cause and correlation in biology: a user’s guide to path analysis, structural equations and causal inference. Cambidge, UK, Cambridge University Press, 2002.
Sims, G. K. “Biological Degradation of Soil”, en: Lal, R., B. A. Stewart (eds.). Advances in Soil Science. Volume 11. Springer, New York, 1990, pp. 289-330.
Steiger, J. H. “Structural model evaluation and modification: An interval estimation approach”, en: Multivariate Behavioral Research. 25, 2. 1990, pp. 173-180.
Stekhoven, D. J. y P. Bühlmann. “Missforest-Non-parametric missing value imputation for mixed-type data”, en: Bioinformatics. 28. 2012, pp. 112-118, DOI: 10.1093/bioinformatics/btr597.
Stevenson, B. A., A. K. Sarmah, R. Smernik, D. W. F. Hunter y S. Fraser. “Soil carbon characterization and nutrient ratios across land uses on two contrasting soils: Their relationships to microbial biomass and function”, en: Soil Biology and Biochemistry. 97. 2016, pp. 50-62.
Tapia-Torres, Y., P. O. Chávez, N. Hernández-Becerra, A. C. Morón, O. Beltrán-Paz y F. García-Oliva. “How do agricultural practices modify soil nutrient dynamics in CCN?” en: García-Oliva, Felipe, James Elser, Valeria Souza (eds.). Ecosystem Ecology and Geochemistry of Cuatro Cienegas. Springer, 2018, pp. 153-161.
Thapa, V. R., R. Ghimire, M. M. Mikha, O. J. Idowu y M. A. Marsalis. “Land Use Effects on Soil Health in Semiarid Drylands”, en: Agricultural & Environmental Letters. 3, 1. 2018.
Vargas, R., M. Detto, D. D. Baldocchi y M. F. Allen. “Multiscale analysis of temporal variability of soil CO2 production as influenced by weather and vegetation”, en: Global Change Biology. 16, 5. 2010, pp. 1589-1605.
Villarreal-Quintanilla, J. Á. y J. A. Encina-Domínguez. “Plantas vasculares endémicas de Coahuila y algunas áreas adyacentes, México”, en: Acta Botánica Mexicana. 70. 2005, pp. 1-46.
Wardle, D. A. “A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil”, en: Biological Reviews. 67, pp. 321-358.
WorldClim. Global Climate Data v. 2.0. 2017 (DE) consultado en junio del 2020 en https://www.worldclim.org/
Working Group WRB, IUSS 2015. Base referencial mundial del recurso suelo 2014. Sistema internacional de clasificación de suelos para la nomenclatura de suelos y la creación de leyendas de mapas de suelos. Actualización 2015. Informes sobre recursos mundiales de suelos 106. Roma, FAO.
Xu, L., D. Baldocchi y J. Tang. “How soil moisture, rain pulses, amd growth alter the response of ecosystem respiration to temperature”, en: Global Biogeochemical Cycles. 18. 2004, pp. 1-10.
Yan, P., H. Peng, L. Yan, S. Zhang, A. Chen y K. Lin. “Spatial variability in soil pH and land use as the main influential factor in the red beds of the Nanxiong Basin, China”, en: PeerJ. 1. 2019, pp. 1-22.
Yang, Y., C. Ji, W. Ma, S. Wang, S. Wang, W. Han, A. Mohammat, D. Robinson y P. Smith. “Significant soil acidification across northern China’s grasslands during 1980s-2000s”, en: Global Change Biology. 18, 7. 2012, pp. 2292-2300.
Zhou, W., G. Han, M. Liu y X. Li. “Effects of soil pH and texture on soil carbon and nitrogen in soil profiles under different land uses in Mun River Basin, Northeast Thailand”, en: PeerJ. 10. 2019.
Anexo